N-杂环卡宾催化剂通过芳基卤键裂解形成芳基自由基
来源:金泽大学(Kanazawa University)
[背景]
芳基卤化物*1) 的苯环直接与卤原子键合,容易获得且化学性质稳定,因此在有机合成中用作苯环的来源。例如,使用有毒锡化合物从芳基卤化物生成高反应性芳基自由基 *2) 的化学反应长期以来一直被认为是提供苯环的方法(图 1A)。近年来,已经开发出化学反应,其中使用金属催化剂或光催化剂*3) 还原芳基卤化物,然后裂解苯环和卤素原子之间的键以生成芳基自由基。然而,由于先前报道的方法需要金属盐和/或过量的氧化剂或还原剂,因此需要对环境影响较小的化学反应。
[结果]
由大宫教授领导的金泽大学研究小组一直在使用新开发的无金属有机催化剂*4)开发新的化学反应,以比传统方法更容易的方式生产各种有用的化学品(参见 EurekAlert! 网页,例如 https://www.eurekalert.org/pub_releases/2020-08/ku-otc081020.php 和 https://www.eurekalert.org/pub_releases/2019-04/ku-mct040219.php)。在本研究中,该小组成功地从芳基碘化物(一种芳基卤化物)生成芳基自由基,在温和条件下,无需轻盐或金属盐,使用 N-杂环卡宾*5) 催化剂和由此形成的芳基自由基用于有机合成(图 1B)。
从由噻唑鎓型 N-杂环卡宾催化剂和醛组成的烯醇化物 *6) 中间体的单电子转移到芳基碘化物,随后苯环和碘原子之间的键断裂,生成芳基自由基催化方式。考虑到烯醇中间体的氧化电位 (Eox = –0.97 V) 和芳基碘化物的还原电位 (Ered = –2.24 V),从烯醇中间体到芳基碘化物的单电子转移,即单电子还原,在热力学上是不利。然而,认为该反应是由于动力学因素而发生的,因为有两个反应步骤,即 1) 从烯醇中间体到芳基碘的单电子转移和 2) 苯环和碘原子之间的键断裂,迅速进行。生成的芳基作为苯环的来源,烯烃*7)进行双官能化,得到苯环取代的酮。另外,利用分子内夺氢反应生成的芳基,进行酰胺的脱氢酰化*8),得到α 6 氨基酮化合物。具有各种官能团的底物可用于这些分子转化反应。药物衍生物也可以通过酰胺的脱氢酰化来合成(图 2)。
[前景]
这项研究的结果是开发了一种化学反应,通过使用对环境影响较小的有机催化剂,使芳基卤化物的苯环和卤素原子之间的键断裂,从而产生芳基自由基。由于广泛用于有机合成的芳基卤化物可以很容易地产生芳基自由基,因此这有望成为精确合成医药和农业药物以及化学材料的强大技术。
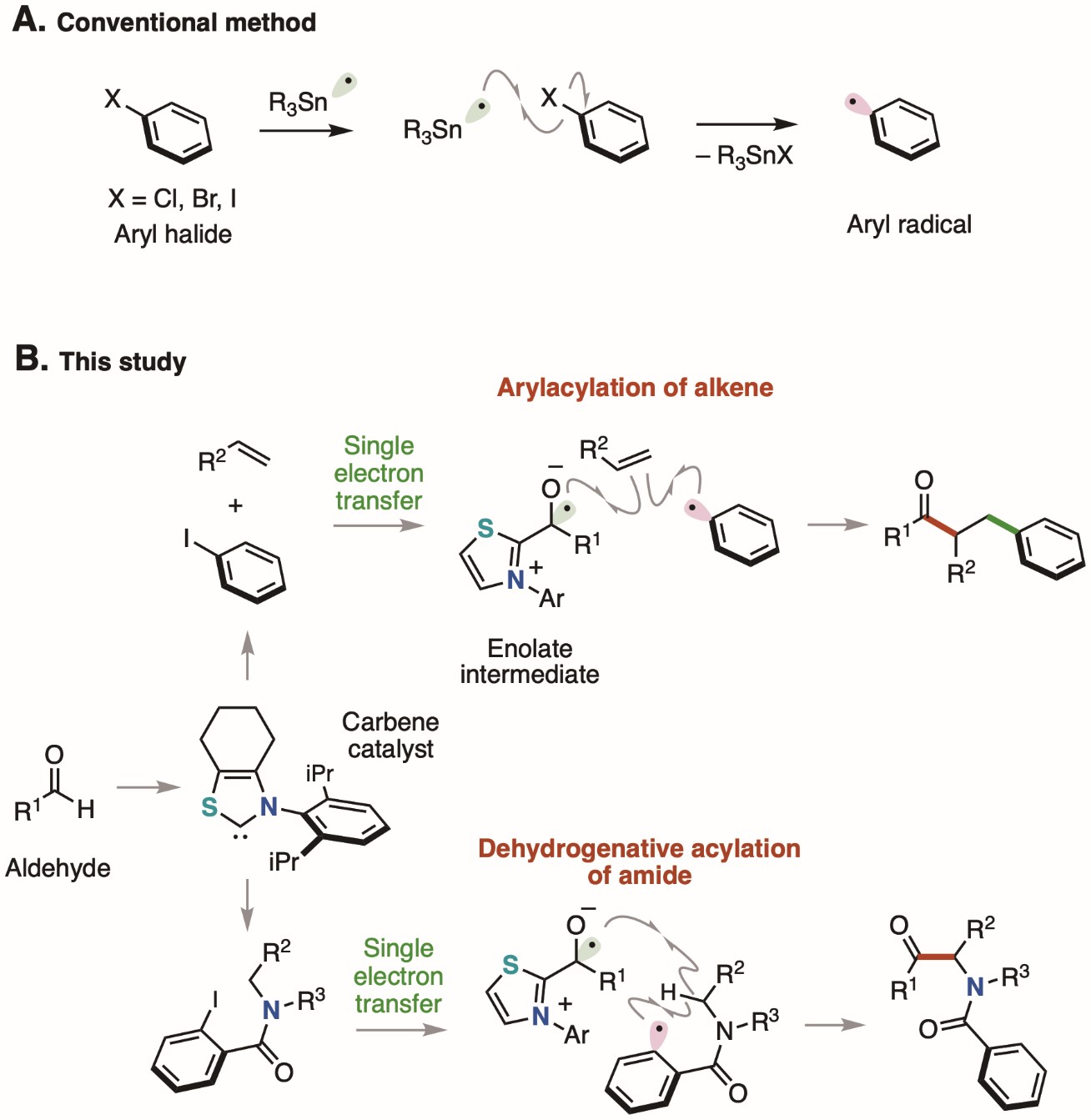
图1. 示意图:常规方法与本研究开发的方法的比较。
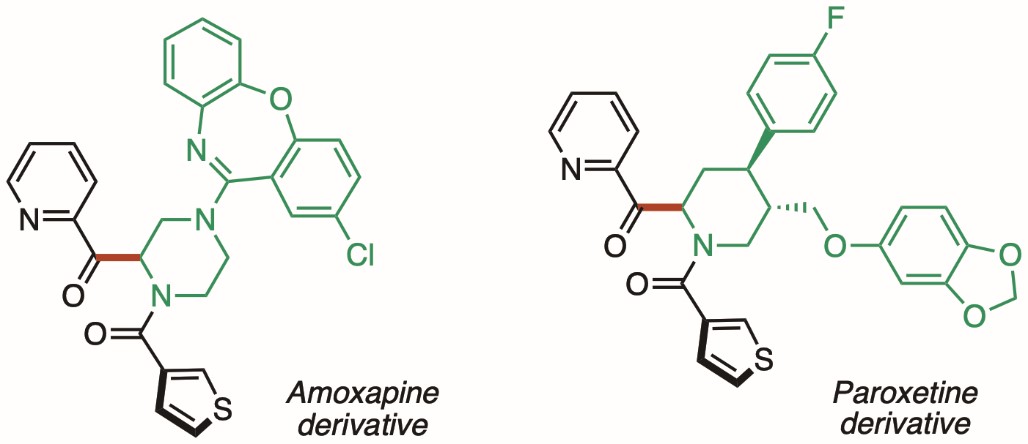
图 2. 通过酰胺脱氢酰化合成的药物衍生物。
[词汇表]
*1) 卤代芳烃
一种化合物,其中芳香(苯)环上的一个氢原子被卤素(F,Cl,Br,I)原子取代。
*2) 芳基
具有不成对电子的芳基(苯环)化合物。
*3) 光催化剂
通过吸收光(这里是可见光)来进行电子或能量转移的催化剂。
*4) 有机催化剂
催化剂是一种化合物,它能促进化学反应的进行,而不会在化学反应前后发生改变。有机催化剂是由碳、氢、氧、氮、硫等元素组成但不含任何金属元素的低分子量有机化合物。
*5) 卡宾
卡宾是一种二价化学物质,含有一个只有6个电子的碳原子。
*6) 烯醇盐
烯酸盐是羰基化合物脱质子化产生的有机阴离子。
*7) 烯烃
在两个相邻的碳原子之间有双键的有机化合物。
*8) 酰化
将酰基引入有机化合物的反应;酰基是羧酸盐的衍生物,不含羟基。
[资助者]
JSPS KAKENHI Grants-in-Aid (JP21H04681, JP17H06449),金泽大学 SAKIGAKE 项目 2020,JST PRESTO (JPMJPR19T2.)。
文章标题:Aryl Radical-Mediated N-Heterocyclic Carbene Catalysis
期刊:Nature Communications
作者:Yuki MATSUKI, Nagisa OHNISHI, Yuki KANEKO, Shunsuke TAKEMOTO, Takuya ISHII, Kazunori NAGAO, and Hirohisa OHMIYA
DOI: 10.1038/s41467-021-24144-2
原文网址:https://www.kanazawa-u.ac.jp/latest-research/94062
声明:本文由凯宝来编译,中文内容仅供参考,一切内容以英文原版为准。
下一页::克服有机化学中的溶解度问题

